NIVELES , SUBNIVELES -
CONFIGURACIÓN ELECTRÓNICA
en la corteza atómica se encuentran los electrones moviéndose alrededor del núcleo atómico.
Los electrones se encuentran en la corteza en diferentes capas o niveles. En cada capa o nivel se puede situar un número máximo de electrones que viene dado por la expresión: nº electrones = 2·n2, donde n es el número de orden de la capa o nivel.
A su vez, los electrones se encuentran en cada nivel distribuidos en diferentes subniveles denominados con las letras s, p d, f, etc. El número de electrones que cabe en cada subnivel es el siguiente:
Subnivel
|
Número de electrones que puede haber como máximo
|
s
|
2
|
p
|
6
|
d
|
10
|
f
|
14
|
El tipo de subnivel que puede tener un nivel dado depende del número de electrones máximo del mismo:
Nivel (n)
|
Número máximo de electrones que se pueden poner (2·n2)
|
Subniveles que tiene
|
1
|
2·12 = 2·1 = 2
|
s
|
2
|
2·22=2·4=8
|
s
p
|
3
|
2·32=2·9=18
|
s
p
d
|
4
|
2·42=2·16=32
|
s
p
d
f
|
Para tener una idea muy aproximada de la distribución de los electrones en los diferentes niveles y subniveles se utiliza el diagrama de Möller. Este diagrama indica el orden de llenado de los subniveles y niveles de energía de un átomo, de arriba hacia abajo, siguiendo el sentido de las flechas, hasta llegar al número de electrones que tiene dicho átomo.

Ejemplo. Escribe la estructura electrónica (distribución de electrones en la corteza) del elemento Ho (Z = 67).
El número de protones coincide con el número atómico, es decir tendrá 67 protones. En el átomo neutro habrá tantos protones como electrones: nº e- = 67. Dibujando el diagrama de Möller, se van cubriendo los huecos hasta alcanzar el número de 67 electrones.

La configuración electrónica es:
1 s2 2 s2 p6 3 s2 p6 d10 4 s2 p6 d10 5 s2 p6 6 s2 4 f11
El subnivel que se está llenando se debe poner al final, en nuestro ejemplo 4 f11.
En química resulta de importancia los electrones más lejanos al núcleo:
- Electrones de los subniveles ‘s’ y / o ‘p’ del último subnivel.
- Electrones de los subniveles ‘d’ o ‘f’ que estén incompletos.
En nuestro ejemplo los electrones que resultan de interés en química serían 6 s2 4 f11 al ser lo que están más lejos del núcleo, resultando más fácil que intervengan en las reacciones químicas habituales.
El resto de los electrones se encuentran en niveles / subniveles más unidos al núcleo, resultando más difícil extraerlos / moverlos a otros nivel en las reacciones químicas habituales.
En cada subnivel hay un número determinado de orbitales que pueden contener, como máximo, 2 electrones cada uno. Así, hay 1 orbital tipo s, 3 orbitales p, 5 orbitales d y 7 del tipo f. De esta forma el número máximo de electrones que admite cada subnivel es: 2 en el s; 6 en el p (2 electrones x 3 orbitales); 10 en el d (2 x 5); 14 en el f (2 x 7)..
La distribución de niveles, subniveles, orbitales y número de electrones posibles en ellos se resume, para las 4 primera capas, en la siguiente tabla:
| Niveles de energía o capa (n) |
1 (K)
|
2 (L)
|
3 (M)
|
4 (N)
|
Tipo de subniveles
|
s
|
s p
|
s p d
|
s p d f
|
Número de orbitales en cada subnivel
|
1
|
1 3
|
1 3 5
|
1 3 5 7
|
Denominación de los orbitales
|
1s
|
2s 2p
|
3s 3p 3d
|
4s 4p 4d 4f
|
Número máximo de electrones en los orbitales
|
2
|
2 - 6
|
2 - 6 - 10
|
2 - 6 - 10 - 14
|
Número máximo de electrones por nivel de energía o capa
|
2
|
8
|
18
|
32
|
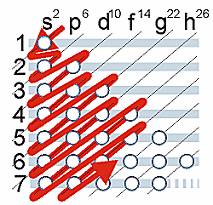
Regla de las diagonales
Sirve para determinar el mapa de configuración electrónica (o periódica) de un elemento
CONFIGURACIÓN ELECTRÓNICA Y TABLA PERIÓDICA
En 1869 el químico ruso Dimitri Mendeleev
propuso una tabulación más amplia de los elementos basada en la recurrencia
periódica y regular de las propiedades. Este segundo intento de sistema
periódico hizo posible la predicción de las propiedades de varios elementos que
aún no habían sido descubiertos. Por ejemplo, Mendeleev propuso la existencia
de un elemento desconocido que llamó eka–aluminio, cuya ubicación debiera ser
inmediatamente bajo el aluminio. Cuando el galio fue descubierto cuatro años
más tarde, se encontró que las propiedades predichas para el eka– aluminio
coincidían notablemente con las observadas en el galio.
En 1913 Moseley ordenó los elementos de la
tabla periódica usando como criterio de clasificación el número atómico.
Enunció la “ley periódica”: "Si los elementos se colocan según aumenta su
número atómico, se observa una variación periódica de sus propiedades físicas y
químicas".
A partir de entonces la clasificación
periódica de los elementos siguió ese criterio, pues en los átomos neutros el
número de protones es igual al de electrones y existe una relación directa
entre el último orbital ocupado por un e- de un átomo (configuración
electrónica) y su posición en la tabla periódica.
La configuración electrónica te dice cuántos electrones tiene el átomo y en qué niveles de energía se ubican. En la tabla periódica los elementos están organizados de menor a mayor cantidad de electrones en su estado neutro.
Por ejemplo el hidrógeno es el primero y su configuración es 1s^1, e helio es el 2 y su configuración es 1s^2, el litio es el tercero y su configuración es 1s^2p^1. Si sumas, te darás cuenta de qe el número del elemento en la tabla es el mismo de la cantidad de electrones.
Bloques de la tabla periódica
La forma de la tabla periódica está íntimamente relacionada con la configuración electrónica de los átomos de los elementos. Por ejemplo, todos los elementos del grupo 1 tienen una configuración de [E] ns1 (donde [E] es la configuración del gas inerte correspondiente), y tienen una gran semejanza en sus propiedades químicas. La capa electrónica más externa se denomina "capa de valencia" y (en una primera aproximación) determina las propiedades químicas. Conviene recordar que el hecho de que las propiedades químicas eran similares para los elementos de un grupo fue descubierto hace más de un siglo, antes incluso de aparecer la idea de configuración electrónica.8 No está claro cómo explica la regla de Madelung (que más bien describe) la tabla periódica,9 ya que algunas propiedades (tales como el estado de oxidación +2 en la primera fila de los metales de transición) serían diferentes con un orden de llenado de orbitales distinto.
CONFIGURACIÓN ELECTRÓNICA DE LOS ELEMENTOS
La forma como están distribuidos los electrones de un átomo entre los distintos orbitales atómicos se denomina configuración electrónica
La configuración electrónica del átomo de un elemento corresponde a la ubicación de los electrones en los orbitales de los diferentes niveles de energía. Aunque el modelo de Scrödinger es exacto sólo para el átomo de Hidrógeno, para otros átomos es aplicable el mismo modelo mediante aproximaciones muy buenas.
Se puede llenar fácilmente la configuración electrónica de la mayor parte de los átomos de los elementos, siempre que se consideren las reglas siguientes:
· Saber el número de electrones que el átomo tiene; basta conocer el número atómico (Z) del átomo en la tabla periódica. Recuerda que el número de electrones en un átomo neutro es igual al número atómico (Z = p+).
· Ubicar los electrones en cada uno de los niveles de energía, comenzando desde el nivel más cercano al núcleo (n = 1).
· No se iniciará el llenado de un nuevo subnivel hasta que el subnivel energético anterior, de menor energía, se haya llenado completamente.
· Respetar la capacidad máxima de cada subnivel (s = 2e-, p = 6e-, d = 10e- y f = 14e-).
Ahora es posible describir la estructura electrónica de los átomos estableciendo el subnivel o distribución orbital de los electrones. Los electrones se colocan, primero, en los subniveles de menor energía, y cuando estos están completamente ocupados, se usa el siguiente subnivel de energía más alto. Esto puede representarse por la siguiente tabla:
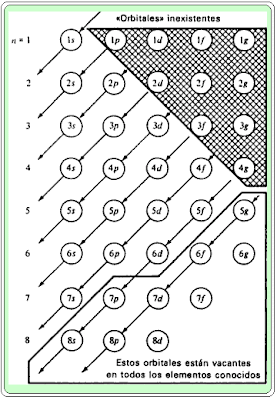
Este cuadro se ajusta estrictamente a la descripción hecha siguiendo el “principio de Aufbau”,
Este comportamiento no contradice aquello de que se llena primero el nivel de menor energía, luego el de mayor energía. Lo que aquí sucede es que hay superposición energética de niveles pues, por ejemplo, el subnivel 4s tiene menos energía que el 3d.
Tanto n como l contribuyen a la energía del subnivel, de modo que si el valor de l es suficientemente grande, la energía asociada al subnivel puede ser mayor que la correspondiente a otro subnivel, aunque este último posea un valor mayor de n. Sumando los valores numéricos de n y de l se puede determinar el orden de llenado.
4s se llena primero que 5d porque:
4s = 4 + 0 = 4 y 3d = 3 + 2 = 5
Sí esta suma fuera igual, regiría el menor valor de n.
Así, 4p se llena primero antes que 5s aunque la suma de los valores es igual.
4p = 4 + 1 = 5 y 5s = 5 + 0 = 5
Las dos excepciones al la regla anterior son 5d y 6d
Para encontrar la configuración electrónica se usa el mismo procedimiento anterior incluyendo esta vez el número máximo de electrones para cada orbital.
También podemos describir la distribución de electrones en el átomo de Litio como:
1s22s1
Esta es la llamada notación convencional

Finalmente la Configuración queda de la siguiente manera:
1s2
|
2s2
|
2p63s2
|
3p64s2
|
3d10 4p65s2
|
4d10 5p66s2
|
4f14 5d106p6 7s2
|
5f14 6d107p6
|



